🧠 En 30 secondes
Quand une infection de prothèse s’installe, le biofilm et les bactéries multirésistantes peuvent mettre les antibiotiques en échec. À Lyon, autour du CRIOAc et des Hospices Civils de Lyon, la phagothérapie (phages ciblant une bactérie précise) ré-ouvre parfois des situations complexes. Objectif : synthèse claire, sourcée, et utile pour les équipes de rééducation.
Aller droit au but
Pourquoi on reparle de phagothérapie dans l’infection de prothèse
La phagothérapie dans l’infection de prothèse suscite un intérêt croissant face à l’augmentation des bactéries multirésistantes. Lorsque les antibiotiques atteignent leurs limites, cette approche développée notamment à Lyon, au sein du CRIOAc, ouvre de nouvelles perspectives pour les professionnels de santé et de la rééducation.
Nous avons tous croisé ces patients après une prothèse de hanche ou de genou : rougeur persistante, douleurs inflammatoires, suintements,
immobilisation prolongée, moral en berne.
Les chirurgies s’enchaînent, le VAC revient, les antibiothérapies s’alourdissent… et pourtant, l’infection résiste.
Dans les situations les plus complexes — souvent liées à Staphylococcus aureus ou Pseudomonas multirésistants — la prise en charge atteint rapidement ses limites.
C’est précisément dans ce contexte que Lyon a remis en lumière une option longtemps restée marginale : la phagothérapie, basée sur l’utilisation de virus capables de cibler spécifiquement la bactérie responsable, y compris au sein du biofilm.
Les travaux menés via PhageInLyon puis le programme Phag-One montrent que cette approche pourrait débloquer certaines infections de prothèse jusque-là considérées comme inextricables.
L’objectif de cet article MonRFS est simple : proposer une synthèse claire, accessible et sourcée, sans promesse excessive, mais avec les données les plus actuelles.
(Références principales : EFORT Open Reviews 2024 – Ferry et al. ; Le Monde 2023 & 2024 ; CRIOAc Lyon ; HCL – Phagothérapie ; revue de biologie médicale 2023.)
Le problème
Biofilm + BMR = traitements lourds, récidives, parcours instable.
L’idée
Phages ciblés = adjuvant possible quand l’impasse se dessine.
Le bénéfice rééduc
Quand l’infection décroche : trajectoire plus stable, progression plus prévisible.
Pourquoi ces infections sont si difficiles à traiter
Les infections de prothèse sont un défi, non seulement pour les chirurgiens et infectiologues, mais pour toute la rééducation : kinés, ostéos, ergothérapeutes, neuropsychologues.
Le biofilm : le verrou majeur
Dès qu’une bactérie touche un implant, elle forme un biofilm, une couche protectrice qui :
- bloque les antibiotiques,
- empêche les défenses immunitaires d’agir,
- permet aux bactéries de se mettre « au repos » et donc de résister aux traitements.
C’est ce qui transforme une infection aiguë en infection chronique, souvent récidivante.
BMR : quand les options se réduisent
Lorsque la bactérie est multirésistante (BMR), les options antibiotiques s’effondrent.
Pour ces patients : traitements plus longs, plus toxiques, parfois sans alternative réelle.
Le parcours patient : long, instable, éprouvant
Les prises en charge classiques impliquent :
- 1 à 3 chirurgies,
- périodes sous VAC,
- immobilisation longue,
- perte d’autonomie,
- douleur chronique,
- détresse psychologique.
Biofilm + BMR = une infection qui “s’accroche”, et une rééducation souvent contrainte pendant des mois.
Phagothérapie : comment ça fonctionne
Un phage est un virus naturel qui cible uniquement une bactérie précise. Il se fixe sur elle, s’y multiplie, puis la détruit.
Pourquoi c’est pertinent dans l’infection de prothèse
- Certains phages peuvent dégrader le biofilm.
- Ils continuent d’agir tant que la bactérie est présente.
- Ils restent efficaces même face à des bactéries multirésistantes.
- Ils s’intègrent en adjuvant : chirurgie + antibiotiques + phages ciblés.
À Lyon, chaque traitement passe par :
- l’isolement de la bactérie du patient,
- un test de sensibilité sur une banque de phages,
- la production pharmaceutique du phage efficace,
- l’administration (locale, intra-articulaire, ou systémique selon les cas).
Les sources scientifiques solides sur ce sujet incluent notamment l’article Ferry et al., EFORT Open Reviews (2024).
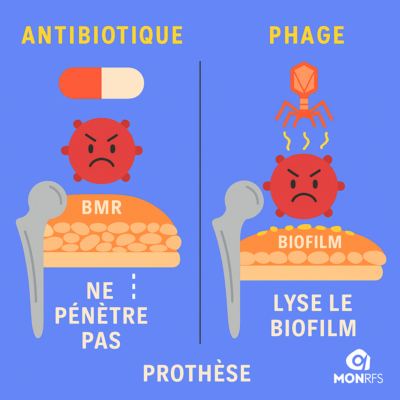
Schéma comparant l’action d’un antibiotique et d’un phage face au biofilm
Lyon / CRIOAc : qui fait quoi ?
Frise (défile horizontalement)
1) CRIOAc Lyon
Centre de référence : évalue, coordonne, valide les indications complexes.
2) PhageInLyon
Démarrage (2017) : banques anti-Staph / anti-Pseudomonas, premières applications.
Structuration : production pharmaceutique, études, encadrement.
4) RCP phagothérapie
Discussion collégiale : sécurité, cohérence, indications rares.
5) Objectif
Éviter les dérives, standardiser, ouvrir des options dans les impasses.
En France, c’est Lyon qui pilote la dynamique.
Ce que ça change (vraiment) pour la rééducation
Plutôt que détailler métier par métier, il est plus utile de comprendre ce que la phagothérapie peut changer globalement pour les équipes de rééducation.
Quand l’infection décroche
- la douleur inflammatoire baisse,
- les rechutes diminuent,
- la progression fonctionnelle redevient prévisible.
Ce que les pros peuvent faire (sans sortir du champ)
- Repérer les signaux inhabituels : rougeur, chaleur, suintement, stagnation.
- Encourager un avis infectiologique / CRIOAc quand le parcours “tourne en rond”.
- Adapter la rééducation dès que la stabilité revient (progressivité, tolérance, autonomie).
- Soutenir le patient sur le plan psychologique (parcours souvent épuisant).
La phagothérapie n’est pas un « traitement miracle ».
Mais dans les impasses thérapeutiques, elle peut rouvrir la porte à une rééducation efficace, ce qui est précisément notre terrain d’action.
Conclusion, la phagothérapie, une option à connaître en cas d’impasse thérapeutique
La phagothérapie n’est pas encore une pratique courante en France, mais Lyon (CRIOAc – HCL) en a fait un champ d’innovation structuré, fondé sur une réelle expertise clinique et scientifique.
Pour la rééducation, cela signifie une chose simple :
certains patients pour lesquels tout semblait bloqué peuvent retrouver une trajectoire de récupération.
Les phages ne remplacent rien. Ils complètent. Ils débloquent.
Et pour des patients en errance depuis des mois, c’est parfois suffisant pour que tout reparte.
Mini-bibliographie
Ferry T., et al. Bacteriophage therapy in musculoskeletal infections. EFORT Open Reviews, 2024;9(5):339-348.
Le Monde Face aux infections multirésistantes, le retour des phages, ces virus tueurs de bactéries.20 février 2023.
Le Monde La phagothérapie, une thérapeutique de rupture à ne pas manquer. 27 août 2024.
CRIOAc Lyon : https://www.crioac-lyon.fr
HCL : https://www.hcl.fr/actualites/phagotherapie
À lire aussi sur MonRFS
Comment intégrer l’EBP sans y laisser votre santé mentale ?
MOOC Simulation Médicale : une approche immersive pour réinventer votre pratique
Le cheveu : baromètre silencieux de notre santé intérieure
Mini-FAQ
La phagothérapie remplace-t-elle les antibiotiques ?
Non. Elle est présentée comme un adjuvant (chirurgie + antibiotiques + phages ciblés) dans des situations sélectionnées.
Pourquoi le biofilm rend-il l’infection si résistante ?
Le biofilm protège la bactérie, freine l’accès des antibiotiques et du système immunitaire, et favorise un état “au repos” plus tolérant aux traitements.
Quel intérêt concret pour la rééducation ?
Quand l’infection se stabilise : moins de rechutes, moins de douleur inflammatoire, et une progression fonctionnelle plus prévisible.



